|
QUANTIFICAÇÃO DE DOENÇAS DE PLANTAS* por Sérgio Almeida de Moraes 1. Importância A quantificação de doenças de plantas, também denominada fitopatometria, visa avaliar os sintomas causados pelos agentes patogênicos nas plantas e seus sinais (estruturas do patógeno associadas aos tecidos doentes). A importância da quantificação das doenças pode ser bem compreendida pelas seguintes frases de autores de textos sobre o assunto: "Diagnose e avaliação de doenças de plantas são duas funções igualmente importantes dos fitopatologistas (JAMES, 1974)". "A medida da intensidade de doenças tem o mesmo papel-chave que a diagnose dentro da fitopatologia (KRANZ, 1988)". "De nada adiantaria conhecer o patógeno de uma doença se não fosse possível quantificar os sintomas por ele causados (AMORIM, 1995)". 2. Principais objetivos a) Estudar a prevalência e importância das doenças na cultura b) Determinar danos ou perdas de rendimento c) Comparar a eficiência de fungicidas d) Determinar a época de aplicação de fungicidas e) Verificar o efeito de práticas agrícolas no controle f) Avaliar a resistência de genótipos aos patógenos no melhoramento g) Estudar o progresso da doença ou de epidemias (primeiros sintomas, curvas de desenvolvimento ou evolução da doença) h) Elaborar modelos de previsão de doenças 3. Métodos de quantificação de doenças As doenças podem ser quantificadas por métodos diretos de avaliação dos sintomas e sinais, como a incidência, severidade, intensidade, e métodos indiretos, como a determinação da população do patógeno, sua distribuição espacial, seus efeitos na produção (danos e/ou perdas), a desfolha causada. 3.1. Métodos diretos A quantificação das doenças é baseada na avaliação dos sintomas e sinais, através da proporção de tecido doente, sendo realizada pelos seguintes parâmetros: :: Incidência :: Severidade :: Intensidade A – Incidência: é o método quantitativo mais comum de medição de doença por ser fácil e rápido, sendo obtido pela da contagem de plantas doentes ou órgãos doentes, através do número e/ou porcentagem (freqüência) de folhas, folíolos, frutos, ramos infectados, sem levar em consideração a quantidade de doença em cada planta ou órgão individualmente. Vantagens: facilidade e rapidez de execução; os resultados obtidos são reprodutíveis, independentemente do avaliador; parâmetro satisfatório na fase inicial da epidemia; pode ser usado na elaboração de curvas de progresso da doença. Desvantagens: método pouco preciso para doenças foliares, mostrando uma correlação duvidosa com a severidade em fases avançadas da epidemia. Só pode ser usado para doenças que afetam a planta toda (patógenos do solo, causadores de murchas e podridões de raízes) ou quando uma única infecção impede a comercialização (podridões de fruto). As avaliações de incidência podem ser feitas de diferentes formas, como nos exemplos a seguir: - Tombamento de plântulas – "stand" de plântulas sobreviventes - Plantas com e sem podridão do colo de A. niger
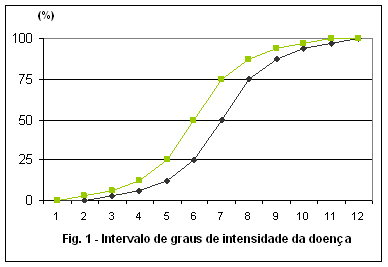
- Contagem do número ou % de espigas de milho com carvão - Número ou % de frutos de maçã com sarna - Número ou % de plantas de algodoeiro com murcha de Fusarium - % de fungos patogênicos em testes de patologia de sementes - Monitoramento do início dos sintomas das manchas preta e castanha do amendoim. A primeira pulverização com fungicida é indicada quando 5 a 15 % dos folíolos estiverem infectados (independente do número de manchas por folíolo). Considera-se infectado cada folíolo da amostra com pelo menos uma mancha visível e bem definida (com mais de 1,0 mm de diâmetro), sendo recomendado separar as manchas preta e castanha para as avaliações (Moraes, 1999). B - Severidade: é um método quantitativo e qualitativo, que procura determinar a porcentagem da área de tecido doente (sintomas e/ou sinais visíveis), através da medição direta da área afetada, com medidores de área em computador ou não, chaves descritivas, diagramáticas, medição automática e sensores remotos. Vantagens: mais preciso expressando o dano real causado pelos patógenos; caracteriza melhor o nível de resistência a um patógeno, expressa com maior fidelidade a intensidade da doença no campo e os danos causados. Desvantagens: mais trabalhoso e demorado, subjetivo, dependente da acuidade do avaliador e da escala. C – Intensidade: é um termo mais amplo que pode ser expresso como incidência ou severidade. Significa o quanto intensa é a doença ou quão doente está a planta. A incidência é um parâmetro satisfatório para avaliar a intensidade de doenças, como murchas e viroses, pois a correlação é alta entre incidência e severidade, pelo fato da doença afetar a planta toda. Para maioria das doenças foliares esta correlação é baixa (incidência de 100% de plantas com ferrugem, não reflete a intensidade real no campo, pois apesar de todas as plantas apresentarem pústulas de ferrugem, a quantidade de pústulas por folha pode ser baixa, causando pouco dano). Ao contrário da incidência a intensidade está estreitamente relacionada com a perda de produção. Numa epidemia de doenças foliares deve-se levar em consideração que, quando a incidência é elevada (maioria das plantas com sintomas), a evolução da doença dá-se quase que exclusivamente pelo aumento do número e tamanho das lesões (severidade). As avaliações de intensidade/severidade podem ser feitas de diferentes formas: I - Medição direta dos sintomas da doença, através da contagem do número de lesões, medição de seu diâmetro, cálculo da área infectada por folíolo [Si= No médio de lesões/ folíolo x (diâmetro médio das lesões/2) x 3,1416] e índice de infecção (I%=Si x 100 / S total), como nas manchas castanha e preta do amendoim (Moraes, 1987). É um método prático para ensaios de pesquisa com número limitado de amostras, por ser muito trabalhoso e demorado. II - Medição visual dos sintomas da doença - os patologistas usam a fotocélula humana (olho) para estimar as intensidades através da medição de áreas doentes e valores de infecção. Para este tipo de medição deve ser considerada a Lei de Weber-Fechner, segundo a qual, a acuidade visual é proporcional ao logaritmo da intensidade de estímulo. Dessa forma descreve 12 graus de intensidade ou severidade das doenças (como mostra a Fig.1):
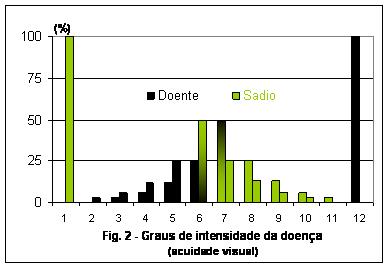
De acordo com o estímulo desses graus de severidade, o olho tende a ler tecido doente abaixo de 50% de área lesionada e tecido sadio acima de 50% (Horsfall & Barrat,1945), conforme mostra o gráfico ilustrativo de acuidade visual para os graus de intensidade da doença (Fig. 2).
Usando esses princípios, as medições visuais da intensidade das doenças podem ser feitas através do uso de chaves descritivas, classes de intensidade, diagramas padrões (James, 1971) ou escalas diagramáticas. a) Chaves descritivas ou classes de severidade da doença – são escalas arbitrárias com certo número de graus ou notas para quantificar as doenças. A seguir são ilustrados diferentes exemplos de chaves descritivas, simples e mais detalhadas, utilizadas para avaliar algumas doenças foliares da cultura do amendoim.
Para a determinação da nota média e o índice de doença (variando de 0 a 100%) das doenças da parte aérea (ferrugem, manchas preta e castanha, verrugose e ferrugem), segundo as escalas de notas apresentadas anteriormente, podem ser utilizadas as equações abaixo: Nota média = n1 x 1 + n2 x 2 + n3 x 3 + n4 x 4) / N. Índice de doença (%) = (n1 x 0 + n2 x 25 + n3 x 50 + n4 x 100) / N, onde: n1, n2, n3 e n4 = número de folíolos da amostra com as notas 1, 2, 3 e 4; N = total de folíolos da amostra Pode-se também determinar o índice de infecção (Moraes & Savy Filho, 1983) através da equação proposta por Amaral (1969):
Escala descritiva proposta por Mazzani
& Hinojosa (1961), para avaliar R0 = nenhuma folha altamente infectada R1 = menos de 25% de folhas altamente infectadas R2 = 25 a 50% de folhas altamente infectadas R3 = 50 a 75% de folhas altamente infectadas R4 = mais de 75% de folhas altamente infectadas
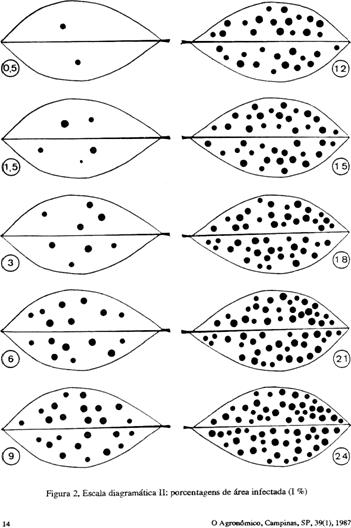
b) Escalas diagramáticas – são representações ilustradas de plantas ou partes de plantas (padrões de comparação), mostrando a área necrosada ou coberta pelos sintomas e sinais do patógeno, em diferentes níveis de severidade. Exemplos de escalas diagramáticas utilizadas para avaliar a mancha preta (Cercosporidium personatum) e a mancha castanha (Cercospora arachidicola) do amendoim são apresentados a seguir.
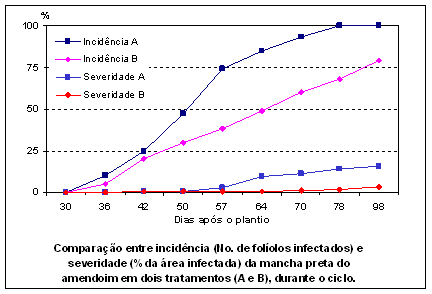
III - Uso da incidência para estimar valores de intensidade da doença A incidência é um parâmetro satisfatório para avaliar a intensidade de doenças, como murchas e viroses, pois a correlação é alta entre a incidência e a severidade, pelo fato da doença afetar a planta toda. Para a maioria das doenças foliares causadas por fungos e bactérias, esta correlação é baixa. Ao contrário da incidência a intensidade está estreitamente relacionada com a perda de produção. Numa epidemia de doenças foliares deve-se levar em consideração que, quando a incidência é elevada (maioria das plantas com sintomas), a evolução da doença dá-se quase que exclusivamente pelo aumento do número e tamanho das lesões (severidade). Para a mancha preta do amendoim (Cercosporidium personatum) índices de incidência de 5 a 15% (porcentagem de folíolos infectados, com pelo menos uma mancha), indicando baixas intensidades, 0,04 e 0,08 % de área foliar infectada, podem ser utilizados para indicar o início da epidemia e a necessidade da primeira pulverização com fungicida para proteger a cultura, impedindo a progressão rápida da doença. Já para estágios avançados da doença a % de folíolos infectados tem pouca relação com a intensidade da doença.
Como ilustra o gráfico acima, a incidência de 100% de folíolos com a mancha preta do amendoim não reflete a intensidade real no campo, pois apesar de todos os folíolos apresentarem manchas, a severidade (% da área infectada por folíolo), pode ser baixa causando pouco dano. IV – Medição da área foliar sadia As dificuldades encontradas nas pesquisas para correlacionar os danos e a intensidade das doenças levaram Waggonner & Berger (1987), a introduzirem um novo conceito baseado na análise da redução da produção induzida pelas doenças, em função da área foliar sadia e não pela quantificação direta das doenças. Aplicando esse conceito para o amendoim e outras culturas, esses autores verificaram que a duração da área foliar sadia ("HAD – healthy leaf area duration", medida em dias) ou a absorção da radiação solar pela área sadia ("HAA – healthy leaf area absorption", medida em MJ m-2) foram os fatores primários determinantes da produção dos cultivares. Esse conceito baseia-se em algumas diferenças entre as avaliações da severidade, pela área sobre a curva de progresso da doença (ASCPD) e pela duração da área foliar sadia (HAD): - A severidade avaliada no inicio ou no fim do ciclo pode resultar em ASCPDs iguais. No entanto, a redução na duração da área foliar sadia (HAD) será menor para a severidade avaliada no início do ciclo (quando a área foliar é menor), do que se a mesma severidade tivesse sido avaliada mais tarde (quando a área foliar é alta); - A diminuição da área foliar pela desfolha dificulta a interpretação da severidade da doença. Assim, se a severidade avaliada é a situação da doença visível, pode-se concluir que numa epidemia onde a doença provoca a desfolha de todas as folhas infectadas, a severidade será menor que numa epidemia em que a doença causa lesões e não desfolha a planta. Porém, é difícil estimar a quantidade e a condição de perda de folhagem causada pela doença ou pela senescência (desfolha natural); - A severidade e a área foliar são resultantes de uma situação visível na cultura. Desse modo, a doença e seu impacto são logicamente analisados pelas características presentes e visíveis no hospedeiro, ou seja, a quantidade e duração de área foliar sadia, que será a responsável pela quantidade de radiação solar absorvida para o processo de fotossíntese e consequentemente para proporcionar a produção. Lopes et al. (1994) propõem a quantificação de danos utilizando equações para determinar as seguintes variáveis:- índice de área foliar ("LAI – leaf area index"), duração da área foliar ("LAD – leaf area duration") e absorção da área foliar ("LAA – leaf area absorption") Para relacionar a curva de progresso da doença e o crescimento deve-se subtrair a área foliar doente da duração da área foliar (LAD), através da integração da área foliar sadia durante o período de crescimento do hospedeiro. Esta integração resulta na duração da área foliar sadia (HAD). Adaptação semelhante pode ser feita com relação à variável absorção da área foliar (LAA), para a obtenção da absorção da área foliar sadia (HAA). Pelo exposto, verifica-se que a determinação da HAD e HAA é muito mais trabalhosa do que avaliar a intensidade das doenças. A intensidade das doenças é uma medida relativa realizada com o auxílio de escalas diagramáticas, enquanto que a HAD e a HAA são medidas absolutas que exigem a determinação real da área foliar, com técnicas de sensoriamento remoto. V - Medição automática e sensoriamento remoto São medições feitas através de: a) Análises de imagem por computador – trata-se da obtenção da imagem de uma amostra com câmara de vídeo, com posterior transferência desta imagem gerada, para realizar a avaliação das áreas sadia e doente, através de programas ("softwares") desenvolvidos para quantificação de algumas doenças. Alguns programas foram feitos para o treinamento na quantificação visual de sintomas de diferentes doenças, através de diagramas em que se procura aprimorar a capacidade de determinação das porcentagens de área foliar doentes. Entre estes estão: DISPRO - Programa computadorizado de treinamento de avaliação de doenças foliares do amendoim, Iowa Univ., EUA, DISTRAIN - Programa computadorizado de treinamento de avaliação da severidade de doenças foliares de cereais, USDA, EUA. QUANT - Software para quantificação de doenças de plantas Autores: Vale, F.X.R; Liberato, J.R.; Fernandes, E.Instituição: Universidade Federal de Viçosa, 2003. b) Sensoriamento remoto – é a quantificação de doenças baseada na radiação refletida das folhagens, através de técnicas que incluem a utilização de fotografias aéreas infravermelhas (com diferentes combinações de filmes, filtros e câmeras) e radiômetros de múltiplo espectro, usados para medir a refletância da folhagem. A radiação refletida das folhagens é função de características da própria espécie vegetal estudada e das condições em que se encontram as plantas, mas as pragas e doenças frequentemente são responsáveis por muitos fatores que afetam a refletância. Em geral os tecidos infectados apresentam menor refletância na região do infravermelho (comprimento de onda > 0,7 um), quando comparados com tecidos sadios, possibilitando a quantificação pelas diferenças de refletância. A refletância é uma medida indireta da área foliar verde, que pode auxiliar na quantificação do efeito do conjunto de patógenos e pragas, sendo útil na viabilização do uso dos novos conceitos de duração da área sadia (HAD) e absorção da radiação foliar pela área sadia (HAA). 3.2. Métodos indiretos de avaliação de doenças A quantificação de determinadas doenças onde os sintomas observados nas plantas são de redução de vigor, enfezamento ou diminuição da produção torna-se difícil através de métodos diretos. Nestes casos são empregados métodos indiretos, como a determinação da população do patógeno, sua distribuição espacial, seus efeitos na produção (danos e/ou perdas), a desfolha causada. a) Indexação e técnicas sorológicas - para muitas viroses, a presença do agente causal não está relacionada com a presença de sintomas visíveis. Assim, para a avaliação dessas doenças são utilizadas técnicas como: - Indexação, procedimento utilizado para a detecção de vírus com o auxílio de plantas indicadoras. - Técnicas sorológicas, como o teste imuno-enzimático de alta sensibilidade, conhecido por ELISA, usadas para quantificar as partículas virais presentes no hospedeiro. b) A contagem de indivíduos, para o caso de nematóides, por métodos específicos, envolvendo amostragem de solo e raízes, serve para orientar as medidas de controle a serem empregadas ou estimar os danos causados por esses organismos. c) A distribuição espacial das doenças causadas por fungos disseminados pelo ar é também um método indireto, que visa medir a quantidade de esporos presentes na atmosfera capaz de causar infecção, com o auxílio de diferentes armadilhas caça-esporos. Constitui-se numa medida complementar para avaliar a distribuição espacial dos agentes de doença no campo. d) A produção ("Yield" em inglês) obtida, ou seja, a quantidade da colheita de uma cultura, em campos tratados e não tratados ou, com e sem doença, é um método indireto de estimar os prejuízos causados pelas doenças. Os sintomas causados por agentes patogênicos são considerados injúrias, que podem resultar em dano ("damage") e/ou perda ("loss"). Procura-se, assim, determinar o dano, redução da colheita ocorrida em função da doença, ou a perda, redução do retorno financeiro devida à ação de agentes patogênicos. e) A desfolha é outro método indireto de medir as conseqüências das doenças de plantas. Pode ser estimada pela contagem direta nas plantas (folhas que caíram e remanescentes na planta) ou por estimativas visuais de porcentagem de desfolha nas plantas ou na área de plantio. É um parâmetro usado para algumas doenças foliares, porém deve-se ter cautela para distinguir a desfolha provocada por agentes patogênicos e a desfolha natural das plantas (senescência). Para isso padrões de comparação (plantas testemunha) devem ser utilizados e sempre analisados em conjunto com quantificações diretas das doenças. 4. Etapas da avaliação
4.1. Técnica de amostragem Após a escolha do método de avaliação, a amostragem é uma das etapas fundamentais para que avaliação das doenças seja representativa da população original, devendo ser feita de maneira criteriosa. Em programas de manejo integrado uma estimativa errada da quantidade de doença, causada pela amostragem incorreta, pode acarretar decisões de controle não adequadas, causando perdas na produção. A escolha da técnica de amostragem depende da distribuição da doença no campo. As principais técnicas são: :: Amostragem ao acaso – doenças com distribuição uniforme no campo. :: Amostragem sistemática – as amostras são coletadas segundo determinados critérios pré-determinados, em função do tipo de distribuição da doença, da finalidade, etc. 4.2. Tipo e tamanho da amostra O tipo e tamanho da amostra dependem da característica da doença, do objetivo do levantamento (avaliações em parcelas experimentais, manejo integrado das doenças, caracterização do nível de resistência, etc.) e do modelo de dispersão da doença. Devem-se estabelecer previamente alguns critérios, como: - tipo de amostra (folhas, folíolos, ramos, planta inteira, frutos, sementes, etc.) - tamanho da amostra (número de folhas, ramos, etc. ou pontos de amostragem) - local ou pontos de amostragem (coleta representativa da planta, área experimental ou da cultura, marcação de plantas ou ramos). - época de amostragem – estádios de crescimento da cultura, em função da característica de cada doença. - número de amostragens durante o ciclo da planta – em função da finalidade, estádio fenológico da planta, curvas de progresso da doença, etc. 5. Referências bibliográficas AMARAL, E. Novo índice de intensidade de infecção. Pesquisa Agropecuária Brasileira, v.4, p.1-2, 1969. AMORIM, L. Avaliação de Doenças. In: Bergamin Filho, A., Kimati, H. & Amorim, L. (ed.) Manual de Fitopatologia: Princípios e conceitos. São Paulo, Editora Agronômica Ceres Ltda., 1995, v.1, cap.32, p.645-671. AZEVEDO, L.A.S. Manual de quantificação de doenças de plantas. São Paulo, 1997,114p. HORSFALL, J. G. & BARRATT, R.W. Na improved grading system for measuring plant disease. Phytopathology v.36, p.655, 1945 (abstract) JAMES, W.C. A manual of assessment keys of plant diseases. Canada Department of Agriculture Publication, No 1458, 1971, 74p. JAMES, W.C. Assessment of plant disease and losses. Annual Review Phytopathology, v.12, p.27-48, 1974. KANUFT, D.A.; GORBET, D.W. & NORDEN, A.J. Yield and market quality of seven peanut genotypes as affected by leafspot disease and harvest date. Peanut Science, v.15, v.9-13, 1988. KRANZ, J. Measuring plant disease In: Kranz, J. & Rotem, J.(ed.) Experimental Techniques in Plant Disease Epidemiology, Heidelberg, Springer, 1988, p.35-50. LOPES, D.B.; BERGER, R.D. & BERGAMIN FILHO, A. Absorção da área foliar sadia (HAA): uma nova abordagem para a quantificação de dano e para o manejo integrado de doença. Summa Phytopathologica, v.20, p.143-151,1994. MAZZANI, B. & HINOJOSA, S. Differencias varietales de susceptibilidad a la roya de mani em Venezuela. Agronomia Tropical, v.11, p41-45, 1961. MORAES, S.A. Monitoramento das doenças foliares do amendoim e avisos climáticos para indicar as pulverizações com fungicidas. O Agronômico, Campinas, v.51, n.2-3, p.86-89, 1999. MORAES, S.A. Escalas diagramáticas para avaliar a intensidade das cercosporioses do amendoim. O Agronômico, v.39, n.1, p.9-18, 1987. MORAES, S.A.; GODOY, I.J. & GERIN, M.A.N. Avaliação de resistência de Arachis hypogaea a Puccinia arachidis, Sphaceloma arachidis e Phoma arachidicola. Fitopatologia brasileira, v.8, p.499-506, l983. RIBEIRO, I.J.A. Relatório das atividades desenvolvidas durante o estágio probatório. Instituto Agronômico de Campinas, 78p., 1970 (Relatório datilografado). SUBRAHMANYAM, P.; McDONALD, D.; GIBBONS. R.W.; NIGAM, S.N. & NEVILL, D.J. Resistance to rust and late leafspot diseases in some genotypes of Arachis hypogaea. Peanut Science v.9, v.6-10, 1982. WAGGONNER, P.E. & BERGER, R.D. Defoliation, disease and growth. Phytopathology, v.77, n.3, p393-398, 1987.
À PqC Dra. Maria Aparecida de Souza Tanaka e à Eng. Agrônoma MS Andrea Rocha Almeida de Moraes pela revisão, sugestões e correções deste texto. (*) Com exemplos de métodos de avaliação de doenças da parte aérea da cultura do amendoim.
Dados para citação bibliográfica(ABNT): MORAES, S.A. de Quantificação de doenças de plantas. 2007. Artigo em Hypertexto. Disponível em: <http://www.infobibos.com/Artigos/2007_1/doencas/index.htm>. Acesso em: Publicado no Infobibos em 15/02/2007 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




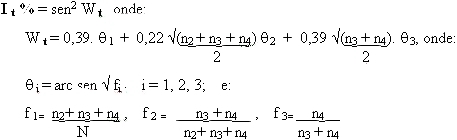


 Sérgio Almeida de Moraes
é
Pesquisador Científico, PqC-VI do Centro P.D. de Fitossanidade do
Instituto Agronômico – IAC, desde 1972.
Engenheiro Agrônomo (1972), Mestre em Fitopatologia (1977) e Doutor
em Agronomia-Área de concentração: Fitopatologia (1981), pela
ESALQ-USP;
Sérgio Almeida de Moraes
é
Pesquisador Científico, PqC-VI do Centro P.D. de Fitossanidade do
Instituto Agronômico – IAC, desde 1972.
Engenheiro Agrônomo (1972), Mestre em Fitopatologia (1977) e Doutor
em Agronomia-Área de concentração: Fitopatologia (1981), pela
ESALQ-USP; 