|
MELHORAMENTO GENÉTICO DO FEIJOEIRO VISANDO A RESISTÊNCIA AS DOENÇAS* por Magno Antonio Patto Ramalho A cultura do feijoeiro no Brasil é submetida a vários estresses bióticos devido a patógenos. Esses, causam redução expressiva na produtividade e afetam a qualidade do produto. Entre as alternativas de controle, o uso de cultivares mais resistentes tem sido procurada. Os programas de melhoramento genético no Brasil tem dado ênfase na obtenção de linhagens mais resistentes às doenças devido aos vírus, fungos e bactérias. Entre as fúngicas a antracnose, incitada pelo Colletotrichum lindemuthianum (Sacc & Magnus) e a mancha angular (Phaeoisariopis griseola) (Sacc & Ferraris) tem recebido maior atenção. O C. lindemuthianum é um fungo que apresenta grande diversidade de raças patogênicas em todo o mundo Balardine & Kelly (1997) & Mahuku e Riascos (2004). No Brasil, vários trabalhos foram realizados a esse respeito. (Alzate Marin & Sartorato, 2004; Silva 2004 e Davide, 2006). Silva (2004) utilizando cultivares diferenciadoras e marcadores de RAPD estudou a variabilidade patogênica de diferentes regiões. Constatou que a maior variabilidade do patógeno foi encontrada dentro das raças, especialmente entre isolados da raça 65 coletados no Estado de Minas Gerais. Encontraram 19 raças, incluindo duas (337 e 593) até então não relatadas no Brasil. As raças 65, seguida das raças 81 e 73 foram as mais freqüentes, devido principalmente ao uso intensivo de cultivares suscetíveis ‘Pérola’ e ‘Carioca’. Alguns trabalhos têm sido conduzidos visando explicar a variabilidade patogênica desse patógeno (Roca, 2002). O controle genético da resistência vem sendo estudado há longo prazo. Uma relação dos genes já descritos e a fonte de resistência é apresentado na tabela 1. Veja que já foram identificados 10 genes, sendo a maioria devido a alelos dominantes e situados em cromossomos diferentes.
Como obter linhagens com resistência a este patógeno? i )A ênfase atual tem sido na piramidação de genes, isto é, adicionar em uma linhagem o maior número possível de genes. Essa estratégia tem sido preconizada principalmente pelos grupos que pesquisam com marcas moleculares. ii) Como o feijão predominante em muitas regiões do Brasil é do tipo ‘Carioca’ uma outra alternativa que provavelmente seja de mais fácil execução, com resistência mais duradoura e certamente com maior estabilidade de produção nos diferentes ambientes de cultivo é a mistura de linhagens possuindo alelos de resistência diferentes dos vários genes conhecidos (multilinhas). iii) Uma outra opção é intensificar a avaliação das progênies e/ou linhagens no maior número de ambientes (locais e safras). É esperado que nessas condições as linhagens mais produtivas sejam resistentes às raças prevalecentes na região de cultivo. Isto ocorreu, por exemplo, com a cultivar BRS – TALISMÃ, que muito embora não tenha sido especificamente avaliada para nenhum patógeno, apenas para produtividade em vários ambientes, foi constatado que ela é resistente a várias raças de C. lindemuthianum e outros patógenos (Souza et al 2005). Com relação a mancha angular, a sua importância no Brasil é crescente. Nos anais do primeiro simpósio brasileiro de feijão, Costa, (1970) comentou que: “A mancha angular é considerada como de relativamente pouca importância econômica nos feijoais de Minas Gerais. Em São Paulo, ela também é considerada como sendo geralmente uma moléstia que aparece nos feijoais em fim de ciclo, quando a produção já está praticamente assegurada ...” Trinta e quatro anos após Paula Júnior (2004) escreveu que “A mancha angular causada por P. griseola é provavelmente a mais importante doença da parte aérea dos feijoeiros” Já Sartorato (2005) comenta que: A mancha angular incitada pelo fungo Phaeiosariopsis griseola (Sacc Ferr) pode ser encontrada em todas as regiões produtoras. Esta enfermidade pode ser responsável por perdas de até 70% na produção ... Como se constata, a importância desse patógeno é crescente. A razão principal é provavelmente o cultivo do feijão em várias épocas durante o ano. É também um fungo com enorme diversidade patogênica. Há evidências que ocorreu a co-evolução patógeno e do hospedeiro, isto é, raças predominantes nos feijões de origem Andina e de origem Mesoamericana. Por essa razão foi proposta a adoção de um conjunto de diferenciadoras envolvendo linhagens andinas e Mesoamericanas (Pastor Corrales & Jara 1995). Sendo a raça identificada por dois números, o primeiro referente as cultivares diferenciadoras Andinas, e o segundo as Mesoamericas. Inúmeros trabalhos existem evidenciando a variabilidade patogência (Sartorato 2002; Sartorato & Alzate Marin 2004). No Brasil, no período de 1996 a 2002 foram identificadas 51 raças, sendo predominantes as de número 31-39, 63-31, 63-23, 63-39, 63-47, 63-55 e 63-63 (Sartorato & Alzate Marin 2004). O controle genético vem sendo estudado há algum tempo. Já foram identificados vários genes envolvidos na resistência (Tabela 2). Veja que, os alelos de resistência identificados até o momento são dominantes (Vieira et al, 2005)
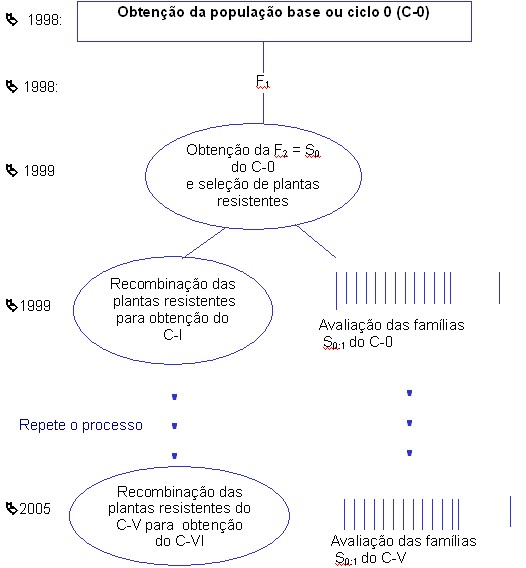
Como são vários genes de resistência, uma estratégia para acumular uma ou mais linhagens a maioria dos alelos resistentes é a seleção recorrente. Isto é, um processo cíclico de melhoramento. Esse procedimento está sendo utilizado no programa da UFLA/Embrapa no Sul e Alto Paranaíba em Minas Gerais. O esquema do processo utilizado até o ciclo V é mostrado na figura 1. Na tabela 3, são relatados os resultados da avaliação das progênies S0:1 dos diferentes ciclos. Veja que a seleção recorrente foi eficiente em aumentar a resistência das linhagens com grãos tipo carioca. Observe também, que a seleção para maior resistência propiciou ganho indireto expressivo (8,9%/ciclo) para a produtividade de grãos. Constatou-se também que ainda há variabilidade para futuros progressos com a seleção.
O progresso genético da cultura de feijão no Brasil nos últimos 30 anos, é expressivo. Há fortes evidências de que grande parte deste progresso foi devido ao melhoramento visando resistência aos patógenos. * Palestra proferida no VI Seminário sobre Pragas, Doenças e Plantas Daninhas do Feijoeiro, realizado no Instituto Agronômico, Campinas-SP, de 14 a 16 de junho de 2006. Referências Bibliográficas SOUZA, T. L. P. O.; RAGAGNIN, V. A.; MELO de P.; ARRUDA, K. M. A.; CARNEIRO, J. E. de S.; MOREIRA, M. A.; BARROS, E. G. Phenotypic and molecular chracterization of cultivar BRSMG. Talismã regarding the principal common bean pathogens. Crop Breeding and applied biotechnology. 5(2): 247-252. 2005. COSTA, A. S. Investigações sobre moléstias do feijoeiro no Brasil. In.: Anais do I simpósio Brasileiro de Feijão. Campinas. 22 a 29 de agosto de 1971. p.305-384. 1972. PAULA JÚNIOR, T. J. de; VIEIRA, R. F. & ZAMBOLIM, L. Manejo integrado de doenças do feijoeiro. Informe Agropecuário 25(223) 99-112. 2004. SARTORATO, A.; ALZATE MARIN, A. L. Analysis of the pathogenic variability of Phaeoisariopsis griseola in Brazil. Bean Improvement Cooperative. 47: 235-236. 2004. VIEIRA, C.; BORÉM, A.; RAMALHO, M. A. P.; CARNEIRO, J. E. de S. Melhoramento do feijão. In: Melhoramento de espécies cultivadas. 2ª edição. UFV. Viçosa. 2005. 301-391. DAVIDE, L. M. C. Reação de cultivares de feijoeiro a diferentes isolados da raça 65 de Colletotrichum lindemuthianum. Dissertação de Mestrado. UFLA. 2006. 66p. BALARDIN, R. S.; KELLY, J. D. Interaction between Colletotrichum lindemuthianum races and gene pool diversity in Phaseolus vulgaris. Journal of the American Society for Horticultural Science, Alexandria, v. 123, n.6, p. 1038-1047, nov. 1998. MAHUKU, G. S.; RIASCOS, J. J. Virulence and molecular diversity within Colletotrichum lindemuthianum isolates from Anden and Mesoamerican bean varieties and regions. European Journal of Plant Pathology. Dordrecht, v. 110, n.3, p.253-263, Mar. 2004. ROCA, M. G M. Recombinação genética em Colletotrichum lindemuthianum por meio de anastomoses entre conídios, 2002. 138p. Tese (Doutorado em genética e Melhoramento de Plantas) – Universidade Federal de Lavras, Lavras, MG. SILVA, K. J. D. Distribuição e caracterização de isolados de Colletotrichum lindemuthianum no Brasil. Lavras; UFLA, 2004. 86p. Dissertação (Mestrado em Genética e Melhoramento de Plantas) Universidade Federal de Lavras, Lavras, MG. PASTOR-CORRALES, M. A.; JARA, C. E. La evolución de Phaeoisariopsis griseola com el frijol común em América Latina. Fitopatologia Colombiana, Santa Fe de Bogota, v. 19, n. 1, p. 15-24, 1995. PAULA Jr., T. J.; VIEIRA, R. F.; ZAMBOLIM, L. Manejo integrado de doenças dos feijoeiro. Informe Agropecuário, Belo Horizonte, v. 25, n. 223, p. 99-112, 2004. SARTORATO, A. Resistance of andean and mesoamerican common bean genotypes to Phaeoisariopsis griseola. Bean Improvement Cooperative. 48: 88-90, 2005
Magno Antonio Patto Ramalho possui graduação em Agronomia
pela Universidade Federal de Lavras (1970), mestrado em Agronomia
Genética e Melhoramento de Plantas pela Escola Superior de
Agricultura Luiz de Queiroz (1973) e doutorado em Agronomia
(Genética e Melhoramento de Plantas) pela Universidade de São Paulo
(1978). Atualmente é professor titular da Universidade Federal de
Lavras. Tem experiência na área de Genética, com ênfase em Genética
Quantitativa, atuando principalmente nos seguintes temas: feijão,
milho, genética quantitativa, melhoramento genético vegetal . Reprodução autorizada desde que citadas a autoria e a fonte Dados para citação bibliográfica(ABNT):
RAMALHO, M.A.P.
Melhoramento genético do feijoeiro visando a resistência as doenças.
2007. Artigo em Hypertexto. Disponível em: <http://www.infobibos.com/Artigos/2007_1/MelFeijoeiro/index.htm>.
Acesso em:
Publicado no Infobibos em 29/01/2007 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||