|
Vírus oncogênicos em animais* por Ana Maria Cristina Rabello Pinto da Fonseca Martins
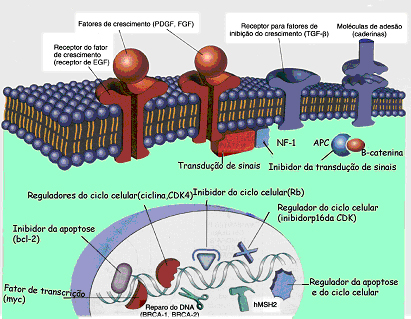
O avanço das técnicas de investigação biomédica e biologia molecular levou a observação da estreita relação entre certos vírus e alguns tipos de câncer em vários animais. Demonstrou-se, assim, que diversos vírus de DNA e RNA são oncogênicos, em uma grande variedade de animais, desde anfíbios até primatas e, há evidências, cada vez maiores, de alguns cânceres humanos terem origem viral. As neoplasias são doenças genéticas e, tanto as benignas como as malignas, originam-se de uma única célula que sofreu lesões genéticas randômicas. Os cânceres, além disso, podem estar envolvidos com as alterações nas restrições normais da proliferação celular, diferenciação e apoptose, sendo que existe um número finito de vias nas quais as restrições podem ocorrer. De fato, alterações em grupos pequenos de genes parecem ser os responsáveis por muitos dos comportamentos desordenados das neoplasias malignas e três classes de genes reguladores normais constituem os principais alvos da lesão genética (Fig. 1): Proto-oncogenes promotores do crescimento, Genes supressores dos inibidores do crescimento de câncer (antioncogene) e Genes que regulam a morte celular programada. Também é pertinente uma 4a classe de genes para a carcinogênese: genes que regulam o reparo do DNA danificado.
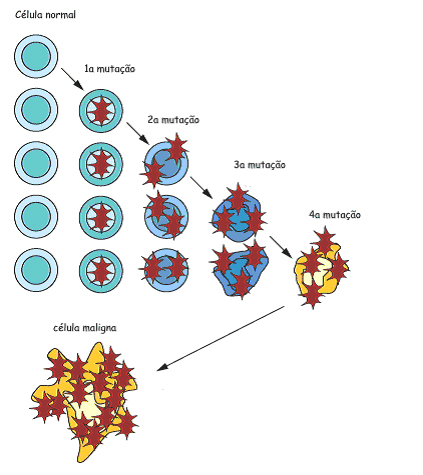
O fenômeno da progressão tumoral leva normalmente muitos anos, reflexo da evolução por mutações e seleção natural entre as células somáticas (generalizando-se, podemos dizer que os tumores benignos, em sua maioria, crescem lentamente no decorrer de um período de anos e a maioria dos malignos cresce rapidamente, muitas vezes em ritmo errático) (Fig. 2). Essa taxa de progressão pode ser acelerada por agentes mutagênicos (iniciadores tumorais) e agentes não mutagênicos (promotores tumorais), que afetam a expressão do gene, estimulam a proliferação celular e alteram o equilíbrio entre células mutantes e não mutantes.
Exemplo de RNA e DNA Vírus podem induzir neoplasias malignas nos animais:
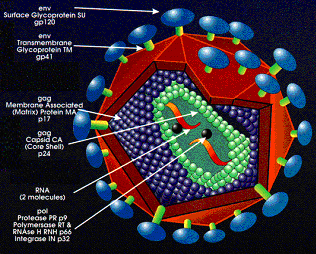
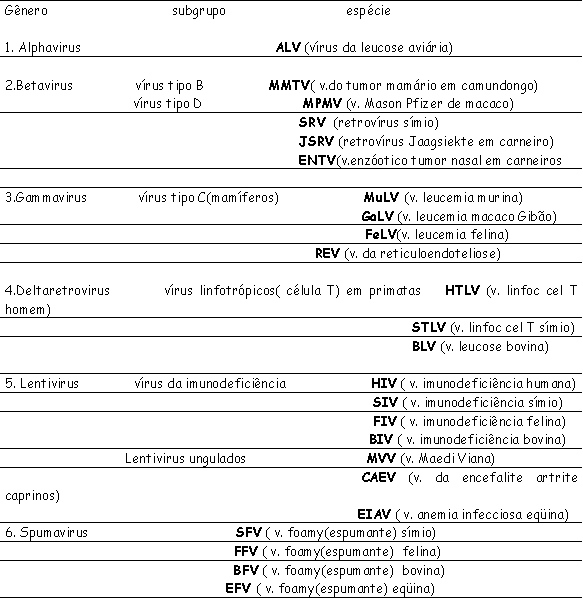
Vírus oncogênicos de DNA Diversos DNA vírus foram associados à causa de neoplasias malignas em animais e no homem. Alguns deles como os adenovírus causam tumores apenas em animais de laboratório e outros, como o vírus do papiloma bovino, provocam neoplasias benignas e malignas no seu hospedeiro natural. Os vírus de DNA transformantes formam associações estáveis com o genoma da célula hospedeira. Esse vírus integrado é incapaz de completar seu ciclo de replicação porque seus genes essenciais para completar seu ciclo de replicação são interrompidos durante a integração do DNA viral. Os genes virais que são transcritos precocemente (genes iniciais) no ciclo de vida do vírus são importantes para a transformação, sendo expressos na célula transformada. Assim, por exemplo, análises moleculares de carcinomas e verrugas benignas por HPV (vírus do papiloma humano) revelam diferenças que podem ser pertinentes para a atividade de transformação desses vírus. Nas verrugas e lesões pré-neoplásicas, o genoma do HPV é mantido em forma epissômica (não integrada) ao passo que nos carcinomas o DNA viral, em geral, está integrado ao genoma da célula hospedeira. Isso sugere que a integração do DNA viral é importante para a transformação maligna. Essa integração é randômica, mas o padrão de integração é clonal (local idêntico em todas as células de determinado câncer). O sítio em que o DNA viral é interrompido durante a integração é bastante constante: quase sempre dentro da estrutura de leitura E1 / E2 do genoma viral (a região E2 do DNA viral normalmente reprime a transcrição dos genes virais E6 e E7 e sua interrupção leva a superexpressão de proteína E6 e E7). Proteína E6 liga-se ao p53 facilitando sua degradação e a proteína E7 liga-se à forma fosforilada da proteína Rb supressora de tumor, deslocando os fatores de transcrição E2 normalmente ligados pela proteína Rb. A co-transfecção com gene ras mutado resulta em transformação maligna completa. Dessa forma provavelmente a infecção por HPV atue como evento iniciador, sendo a ocorrência de mutação somática essencial para a transformação maligna, como, por exemplo, a presença de infecções microbianas coexistentes, deficiência protéico, alterações hormonais. No homem, o HBV pode causar hepatocarcinoma e seu DNA está integrado no DNA da célula hospedeira com inserções também clonais. Entretanto, o genoma do HBV não codifica qualquer oncoproteína e também não tem um padrão consistente de integração na vizinhança de qualquer protooncogene. Assim, acredita-se que o efeito do HBV seja indireto e possivelmente multifatorial: a lesão crônica dos hepatócitos e a hiperplasia regenerativa pelo HBV podem levar ao aparecimento de mutações espontâneas ou podem ser provocadas por agentes ambientais como aflatoxina na dieta. Além disso, o HBV codifica um elemento regulador, a proteína Hbx, que desorganiza o controle normal de crescimento de hepatócitos infectados por provocar a transcrição de vários genes promotores de crescimento como o fator de crescimento insulina II. A proteína Hbx liga-se a p53 e assim parece interferir na sua atividade de supressor de tumor. HERPES (O mais importante oncogênico dos vírus DNA). Associa-se com carcinomas uterinos e de cérvix (Herpes II), com o carcinoma nasofaringeano e com o linfoma de Burkitt (vírus de Epstein-Barr/da mononucleose infecciosa), com a "doença de MAREK" ("Herpes Vírus of Turkey” /vacinação profilática que não protege contra a infecção, mas sim contra a formação da neoplasia), com o "adenocarcinoma renal de rãs de LUCKÉ" (único exemplo de vírus oncogênico dependente de temperatura/ no inverno o tumor não cresce, mas produz vírus; enquanto que no verão o tumor cresce, mas não produz vírus). PAPOVA (Papilomas/ cães, bovinos, homem?; Poliomas/ infecção inaparentes em camundongos adultos e neoplasias em recém nascidos; Vacuoloma/ Símio Vacuolizante 40 - obtido de culturas de células renais de macacos Rhesus ocasionando sarcomas em hamster recém nascido). Podem ocasionar: a) Infecção produtiva com lise celular; b) Transformação ou iniciação (inserção do DNA viral no genoma celular ocasionando perda do controle do crescimento celular). ADENOVIRUS Tumores produzidos somente em condições de laboratório. Vírus oncogênicos de RNA Os vírus da subfamília Oncoviridae são os principais agentes de leucemia (leucose) e linfomas em muitas espécies animais como bovinos, felinos, símios, murinos e aves. Esses retrovírus agrupam-se em diferentes gêneros, mas o gênero mais numeroso é o com vírus de morfologia tipo C e, também, o com maior envolvimento na tumorigênese. Retrovírus defeituosos e não defeituosos Retrovírus endógeno não defeituoso típico contém 2 cópias idênticas de uma molécula de RNA e cada uma delas contem 3 genes: GAG (codifica as 4 proteínas nucleares), pol (codifica a única polimerase vírica ativa: transcriptase reversa) e env (codifica 2 glicoproteínas do envoltório). Retrovírus exógeno transformante rápido contém um 4o gene, onc Como esse oncogene se incorpora no RNA viral ocupando parte de um ou mais genes virais normais, o genoma resultante será defeituoso e, portanto para que ocorra sua replicação há necessidade de retrovírus cooperadores não defeituosos. Exceção é o vírus do sarcoma de Rous, muito usado em experimentos clássicos. Seu genoma é atípico porque contém um oncogene viral (v-onc) e cópias completas de todos os outros genes retrovirais (gag, pol e env). Retrovírus endógenos e exógenos Retrovírus endógeno: Uma cópia DNA completa do genoma (provírus), em determinadas situações, em muitas espécies de retrovírus, pode ser transmitida ao DNA da linhagem germinal materna à prole por herança mendeliana. Perpetua-se, assim, esse DNA em todas as células de um indivíduo em algumas espécies de vertebrados. Ex: retrovírus PERV-A e PERV-B em suínos. Esses genomas provirais são controlados pelos genes reguladores das células e normalmente são silenciosos devido à mutações, deleções ou transposições. Segundo Blaise et al. (2003), seqüências endógenas de retrovírus representam 8% do genoma humano. Sugere-se que esses provírus possam ser ativados por diversos fatores como radiações, exposição a substâncias químicas mutagênicas ou carcinogênicas, hormônios e etc. Retrovírus exógeno: retrovírus com comportamento infeccioso típico, disseminando-se horizontalmente por contacto. Muitos retrovírus exógenos são recombinantes produzidos em laboratório ou por co-infecção casual de um animal, não se encontrando como provírus endógeno na natureza (Tabela 1).
Tumorigenicidade Muitos dos retrovírus endógenos não produzem enfermidade, não transformam células em cultura, não contendo oncogene em seu genoma, mas podem ser ativados, eventualmente, sob determinadas circunstâncias estressantes, como citado anteriormente. Ao contrário, a maioria do retrovírus exógenos é tumorigênica, induzindo leucemias, linfomas, sarcomas, carcinomas com predileção por determinada célula. São vírus transformantes rápidos ou lentos. Os retrovírus transformantes rápidos, como vírus do sarcoma de Rous, contêm em seu genoma um oncogene viral (v-onc). Os transformantes lentos não contêm oncogenes virais, mas podem induzir leucemias Célula T, B ou mielóides, como por exemplo, a leucose aviária, viremia por toda a vida da ave, sem manifestar a doença normalmente. Oncogenes A proteína codificada por esses genes é necessária e suficiente para a inicialização e manutenção da transformação. Não são necessários para a replicação viral. Na verdade forma-se a partir de um gene c-onc (protooncogene) que se incorporou acidentalmente por recombinação com o genoma viral. Existem +/- 20 c-onc com papel fundamental na divisão e diferenciação normais da célula. Provavelmente um v-onc dos retrovírus derivou dos c-onc durante a recombinação do DNA provírus e DNA celular. Transdução de um oncogene por retrovírus O gene c-onc adquirido por recombinação passa a fazer parte do genoma viral como v-onc. Posteriormente com a integração do provírus no genoma celular, observa-se alta taxa de mutação pontual, deleção e várias redistribuições (portanto o v-onc difere de seu progenitor c-onc codificando proteínas diferentes). Quando posteriormente se insere no genoma de outra célula, o v-onc é controlado por poderosos promotores e potenciadores do LTR (repetições terminais longas). Ativação de um oncogene celular O c-onc é responsável por algumas transformações, por ex, por sua hiperexpressividade ou expressão inadequada. Essa expressão anômala ocorre por diferentes vias: Mutagênese insercional: integração de um provírus com seus potentes elementos promotores e potenciadores próximo a um c-onc. Isso leva a um aumento da expressão do c-onc. Ex.: vírus da leucemia aviária, carentes de v-onc, mas com LTR ativando o c-onc. Transposição: Transposição de c-onc pode levar a um aumento de sua expressão se sob controle de fortes elementos potenciadores e promotores. Ex.: Translocação do 8:14 no linfoma de Burkitt. Assim a justaposição do c-myc com genes da Ig e c-myc passa a ficar sob controle de potentes promotores da Ig. Amplificação gênica: Aumento do número de cópias de um c-onc leva a um aumento da proteína expressa por esse gene. Mutação: Mutação do c-onc, por ex, c-ras, aumenta a função da proteína codificada. Essas mutações podem ocorrer in situ sob influência de carcinógenos químicos e físicos e pela recombinação com o DNA dos retrovírus. Algumas mudanças comuns observadas em cultura celular quando transfectas por vírus oncogênicos
A) Anormalidades da membrana
plasmática Características ultraestruturais:
As
alterações subcelulares mais freqüentes nas neoplasias são: Alterações Bioquímicas Gerais: Aparentemente pouco significativas e pouco características, as alterações bioquímicas podem ocorrer na constituição celular ou podem acarretar o aparecimento de enzimas anormais. Na Constituição Celular:
1.
Diminuição da amplitude enzimática (ocorrendo simplificação no
metabolismo pós-diferenciação, com diminuição das enzimas normais e
aparecimento de enzimas anormais). Aparecimento de Enzimas Anormais: Explica as alterações no metabolismo energético, as alterações no metabolismo protílico (com síntese de neo-Ag/ alterações antigênicas, e/ou com síntese de hormônios polipeptídeos e somatomedinas/ síndromes paraneoplásicas). De acordo com a morfologia vírica à M.E., os RNA vírus são classificados em:
•
Partículas tipo A -
associados às neoplasias de camundongos, Diferentemente do que ocorre com os DNA vírus, a célula parasitada por um RNA oncogênico é simultaneamente transformada em oncócito ao tempo em que age como fonte de produção de novos vírions. Existem muitas controvérsias na subclassificação dos RNA vírus, porém são citadas como famílias de importância oncogênica os leucovirus, os oncornavirus e os retrovirus (assim chamados por causa da transcriptase reversa ou Polimerase de DNA dependente em RNA, que faz uma cópia DNA/ "Pró vírus" do RNA vírico e o insere no genoma da célula hospedeira). Importante salientar que todos os oncornavirus são retrovirus, mas nem todos retrovirus são oncornavirus. Referências bibliográficas
ASCH BB.Tumor
viruses and endogenous retrotransposons in mammary tumorigenesis.Trends
Microbiol . v.:7(9), p.350-6, 1999 http://pathmicro.med.sc.edu/lecture/RETRO.HTM
http://www.opusgay.org/HIV-DST.html LOWER R. The pathogenic potential of endogenous retroviruses: facts and fantasies Trends Microbiol. v:7(9):350-6 , 1999 PALMARINI, M, HALLWIRTH C., YORK D, MURGIA C, OLIVEIRA T, SPENCER T, FAN H1Molecular Cloning and Functional Analysis of Three Type D Endogenous Retroviruses of Sheep Reveal a Different Cell
Tropism from That of the Highly Related Exogenous J. VIROLOGY, , v.
74, n. 17,p. 8065-8076,2000 * Origem: Instituto Biológico - www.biologico.sp.gov.br
Dados para citação bibliográfica(ABNT): MARTINS, A.M.C.R.P.F Vírus oncogênicos em animais. 2007. Artigo em Hypertexto. Disponível em: <http://www.infobibos.com/Artigos/2007_2/Virus/index.htm>. Acesso em: Publicado no Infobibos em 27/06/2007
 |