|
A MATURAÇÃO FISIOLÓGICA DA VIDEIRA VINÍFERA EM SÃO PAULO: Comentários sobre as safras de verão e de inverno na média altitude paulista
Antonio Odair Santos A qualidade do vinho é diretamente ligada ao ponto ótimo da maturação da uva, sendo este um evento que envolve a maturação fisiológica (biossíntese evolucionária na baga), da maturação tecnológica (acúmulo de açúcar + ácidos) e da maturação fenólica (acúmulo quali-quantitativo de taninos, pigmentos e compostos ligados ao sabor e aroma) (Mandelli et al. 2003). A localização do vinhedo e o seu manejo têm fundamental importância neste aspecto. A investigação sobre o tema tem sido feita para identificar estratégias de manejo que possam levar a otimização da maturação, contudo para o melhor entendimento sobre estas estratégias faz-se necessário considerarmos a formação e desenvolvimento da baga. Para isso é necessário observar primeiro as condições críticas da sua formação e as influências de variáveis microclimáticas sobre o processo de maturação fisiológica.
O fruto da videira é essencialmente uma fábrica bioquímica. Além da síntese dos metabólitos essenciais primários (água, aminoácidos, minerais, micronutrientes) a baga tem a habilidade de sintetizar outros componentes que podem definir um vinho em particular (p.e. componentes de sabor e aroma) (Gholami et al 1995).
Há um potencial para uma grande variabilidade na maturação da produção da videira, dentro do cacho, de cacho a cacho e dentro do vinhedo. Na prática é difícil determinar quando um vinhedo um pouco mais extenso está expressando o melhor potencial de maturação. Um dos objetivos, no velho e novo mundo, tem sido produzir uma vindima o mais uniforme possível, quanto aos índices de maturação (Wample et al, 2006; Santos et al, 2008). Neste espírito a melhor vindima seria aquela que resulta de um vinhedo com maturação uniforme, bagas pequenas com a maturação tecnológica da baga “par e passo” com a maturação fenólica.
A baga é alimentada através do pedicelo por um sistema vascular composto do xilema e floema. O xilema é o sistema de vasos responsável pelo transporte da água, minerais, reguladores do crescimento e nutrientes do sistema radicular para o resto da planta. Evidências atuais indicam que o xilema é funcional na baga até a “pinta”; posteriormente esta função é reduzida ou eliminada. A baga também é suprida pelo floema, que é o sistema vascular transportador dos fotossintetizados (sucrose) das folhas para a planta; esta função é reduzida no início do desenvolvimento da baga, mas tornase a principal fonte de ingresso após a “pinta”(Greenspan et al 1994).
O aumento no volume da baga, primariamente devido à água, está associado ao aumento de açúcar após a “pinta”. Contudo em algumas variedades (notadamente Syrah), principalmente se cultivada sob clima quente e seco, o aumento em açúcar durante os estágios finais da maturação não é acompanhado pelo aumento do volume da baga, mas é causado pelo murchamento da mesma. Esse murchamento parece estar relacionado com a transpiração da baga (McCarthy, 1999; Santos & Kaye, 2009), o que sugere que a inabilidade da baga para permanecer em ótima hidratação nesse ponto do ciclo é devido ao bloqueio de elementos do floema dentro da baga. Suspeita-se que, para algumas variedades, o sistema vascular entre a videira e a baga tem a função reduzida durante a parte final da maturação da baga.
Desenvolvimento das fases inicias da baga O desenvolvimento da baga consiste de duas curvas sigmóides sucessivas de crescimento, separadas por um “retardo”. O primeiro período de crescimento tem início na floração, estendendo-se até aproximadamente 60 dias. Durante o primeiro período de crescimento a baga é formada e os embriões da semente são produzidos; uma rápida divisão celular ocorre nas primeiras semanas e, no final deste período, o total do número de células da baga está estabelecido (Harris et al., 1968). A dimensão na divisão celular tem importância no eventual tamanho da baga e, a dinâmica da água no solo influencia esse processo. Há vários solutos que acumulam na baga durante este primeiro período, e todos aparentemente atingem um máximo ao redor da “pinta” (Possner et al.,1985). Os mais importantes são o ácido málico e tartárico, sendo que o ácido tartárico é o que é sintetizado primeiro, no inicio do período. Estes ácidos compõem a acidez do vinho e, portanto, são críticos para a qualidade do mesmo. Igualmente, no primeiro período acumulam-se os ácidos hidroxicinámicos, importantes, devido ao seu envolvimento com reações de escurecimento e porque são precursores de fenóis voláteis (Licker et al., 1999). Os taninos, incluindo as catequinas monoméricas também se acumulam no primeiro período de crescimento da baga. Estão presentes na casca e na semente e quase ausentes na polpa; são responsáveis por caracteres de amargor e adstringência no vinho e também importantes na fixação da cor (Kennedy et al., 2001). Há outros componentes, não menos importantes para a qualidade do vinho, que se acumulam na primeira fase de crescimento: minerais, aminoácidos, micronutrientes e componentes do aroma (p.e. metoxipirazinas).
Desenvolvimento do segundo período de crescimento O início da segunda fase de crescimento da baga coincide com a “pinta” e é caracterizado pelo amolecimento e coloração do fruto; praticamente dobra em tamanho entre o início da segunda fase de crescimento e a colheita. Muitos dos solutos que acumularam na primeira fase de crescimento permanecem na colheita; contudo, devido ao aumento de volume da baga, a concentração é reduzida significantemente. Alguns compostos produzidos durante o primeiro estágio de crescimento da baga são reduzidos (e não diluídos) durante a segunda fase decrescimento (g/baga). Entre eles, o ácido málico, usado como fonte de energia durante o processo de maturação. Esta redução varia consideravelmente, mas pode ser empiricamente correlacionado com as condições climáticas. Videiras cultivadas em regiões quentes tendem a ter menos ácido málico que aquelas cultivadas em regiões frias; taninos também declinam consideravelmente durante a segunda fase de crescimento (g/baga). Os taninos presentes na semente aparentemente sofrem oxidação ao tempo em que se tornam fixos na pele da semente. Como resultado, a composição dos taninos extraíveis das sementes mudam consideravelmente e é caracterizada pela redução proporcional nos componentes tânicos amargos (Kennedy et al., 2000). Os taninos da casca declinam ou permanecem constantes durante a segunda fase de crescimento da baga e igualmente sofrem modificações, sobretudo pela ação da antocinanina e pectinas, o que tem implicância para a textura e estabilidade da cor no vinho.
Notadamente, componentes aromáticos que são sintetizados na primeira fase de crescimento da baga declinam (g/baga) durante o amadurecimento da baga. Isto inclui vários dos compostos de metoxipirazinas, responsáveis pelo caráter vegetal/herbáceo de alguns vinhos (p.e. Cabernet Sauvignon e Sauvignon Blanc). O declínio nos níveis de pirazinas está relacionado com os níveis de radiação solar incidente na zona de frutificação e com a dinâmica da água no solo, dentre outros fatores (Hashizume e Samuta, 1999). Portanto, ocasionalmente sendo estes compostos indesejáveis em certos níveis, o manejo no vinhedo pode ser usado para reduzi-los.
Na segunda fase de crescimento tem-se um grande aumento em compostos (a maior parte glicose e frutose) que ocorre como resultado da mudança bioquímica no modo de maturação do fruto. No começo da “pinta” o fluxo de açúcar para a baga inicia, sendo que a sucrose produzida na fotossíntese é importada para dentro da baga e hidrolizada para glicose e frutose (Robinson & Davis, 2000). A eventual concentração também depende de outros fatores como variedade, regime microclimático, índice de carga, dimensão do dossel, estado fitossanitário e eventual sobrematuração.
Em que pese o acúmulo de açúcar ser importante, o maior determinante da qualidade do vinho são os metabólitos secundários. Nas variedades tintas a produção de antocianina, restrita a casca do fruto na maioria das cultivares, é o composto de importância mais obvia; doravante, tanto quanto para variedades brancas a maioria dos compostos aromáticos voláteis são produzidos durante esta fase da maturação do fruto (Wilson et al., 1984). Estes últimos se referem aos compostos da classe dos terpenóides (a maior parte monoterpenos) que são importantes aromas florais presentes em muitas variedades, como Riesling e ‘Moscatos’, juntamente com precursores de aromas frutados. Os componentes do aroma são distribuídos na polpa e na casca do fruto; alguns destes são apenas precursores, estando presentes na baga como glicosidios, não sendo voláteis (quando são) até que o vinho tenha sido produzido e submetido a guarda (Francis et al., 1999).
Impactos do
microclima sobre maturação fisiológica e fenólica A maturação da baga é altamente dependente da temperatura do ar, assim como qualquer reação bioquímica-enzimática. O processo de maturação do fruto tem a temperatura ótima, abaixo ou acima do qual o processo perde intensidade. A curva de resposta a temperatura para cada um dos processos descritos não é totalmente entendida. Contudo, ela ocorre, provavelmente, ao redor de 30 a 32 ºC. Acima destes limites as taxas decrescem rapidamente. Abaixo destes valores as taxas decrescem com menor aceleração, cessando ao redor de 10 ºC.
A soma térmica na estação de crescimento pode ser verificada através do conceito de graus-dia (Pedro-Jr et al., 2004). Desta maneira pode se monitorar a atividade biológica do fruto durante a estação de crescimento. A soma térmica é útil como indicador da capacidade do local para a maturação de determinada variedade. Contudo, é importante observar o padrão comportamental da soma térmica . É possível que duas localidades com a mesma soma térmica tenham diferentes janelas climáticofenológicas. Particularmente, latitudes maiores ou regiões de altitude frequentemente têm baixa soma térmica em ambas a pontas (fim e inicio da estação) fazendo-se necessário usar variedades que possam tolerar uma janela climática mais curta.
A soma térmica é um bom indicador inicial da influência climática sobre um vinhedo em particular. Mas, pode não ser suficiente para descrever como o microclima influencia a maturação, especificamente. A média diurna da temperatura do ar durante a maturação é útil para este propósito. A diferença entre a temperatura do ar diurna e noturna, assim como as temperaturas míninas nos dois períodos são reveladoras das condições para a maturação de um vinhedo em um local particular.
O velho ditado “dias quentes e noites frias” não necessariamente descreve uma situação ideal. Contudo se uma região tem dias quentes, noites frias são essenciais para prevenir o rápido metabolismo ácido. Um clima com dias quentes e noites quentes, produz um diferente (não necessariamente inferior) estilo de vinho, na comparação com uma região ainda com a mesma soma térmica, mas desta feita, com dias quentes e noites frias. Quando temperaturas noturnas se aproximam de 10 graus Celsius a baga cessa a maturação. Quando a temperatura noturna eleva-se acima daquele patamar, a maturação continua dentro da noite. Assumindo-se que a temperatura diurna aproxima-se do ótimo para maturação, a menor flutuação térmica diária produz a maturação mais rápido que climas com larga flutuação térmica diária. Na prática, para uma determinada variedade, microclimas com menor flutuação térmica diária geralmente matura o fruto a taxas mais altas de sucrose, na comparação com climas com larga flutuação térmica e maiores índices de nebulosidade e com similar soma térmica.
Por outro lado, a radiação solar tem grande importância no desenvolvimento de antocianina na casca do fruto das variedades tintas. Por isso um dossel congestionado ou uma zona de frutificação muito coberta tende a produzir coloração pobre na baga. Contudo, somente cerca de 10 % do total da radiação solar global incidente é necessário para produzir o efeito desejado (Deloire & Hunter, 2005). Aumentando-se os níveis de radiação solar pode-se incorrer em riscos de escaldadura.
A luz ultravioleta também tem mostrado influenciar a concentração de flavonóis na baga. Esse efeito foi provado ser separado do efeito da temperatura (Spayd et al., 2002). Os flavonóis tais como quercetina e kaempferol são protetores solares naturais da baga; são importantes antioxidantes com importante contribuição medicinal no vinho; a contribuição em sabor e aroma no vinho não é garantida, mas podem em certos casos influenciar a percepção sensorial de outros elementos aromáticos.
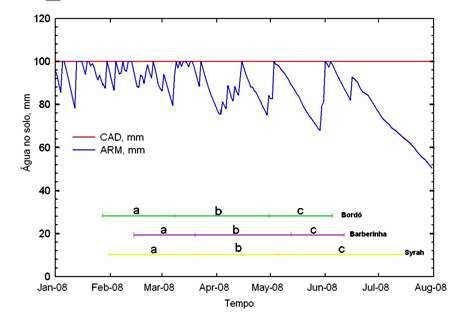
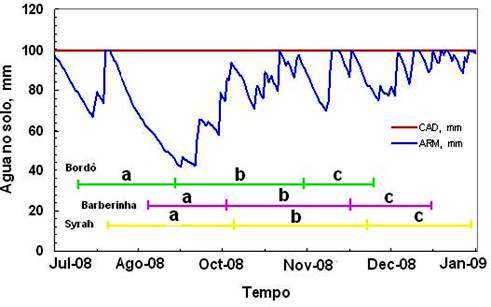
As Tabelas 1 e 2 se referem aos dados do ciclo da videira colhida no verão (poda normal, no inverno) e colhida no inverno (poda no verão) em São Paulo. Os dados dão uma boa idéia sobre as condições de maturação da uva na média altitude paulista. Verifica-se que a maturação fisiológica da baga é jogada em quadrantes diferentes das estações do crescimento, no que se refere a soma térmica e disponibilidade hídrica, o que resulta em condições diferenciadas para a maturação tecnológica e fenólica da uva.
Para a safra de verão (SV) a soma térmica disponível para cumprir o ciclo é maior que a safra de inverno (SI), sendo que a flutuação térmica diurna é menor nesta última, o que contribui para que ‘Syrah’ tenha o ciclo expandido. Por outro lado, a intensidade de cor é maior na colheita de inverno, sendo que a formação e maturação da baga ocorreram sob condições de disponibilidade hídrica declinante (Figura 1); em comparação com o cultivo do verão, ocorre o contrário, verificando-se o armazenamento hídrico crescente, no período de maturação (Figura 2). Notadamente, se tem para a safra de verão e de inverno um número de dias com chuva semelhantes nos dois eventos, porém a concentração da chuva se dá em épocas diferentes do ciclo, o que faz a diferença. Este detalhe tem particular importância e mostra que as condições para a maturação fisiológica e fenólica da videira no outono/inverno (SI) são mais favoráveis, principalmente para Vitis vinifera. Para as variedades americanas e híbridas, menos exigentes que as viníferas verdadeiras, as condições da SV e da SI tendem produzir resultados menos contrastantes, considerando-se somente a disponibilidade térmica e hídrica; a pressão fitopatológica esperada também é menor na SI, muito embora o desenvolvimento dos ramos da videira, neste período, ainda coincida com um período de precipitação mais intenso.
Os dados sobre peso dos cachos e o peso de bagas evidenciam que para SI a produção é menor, com tamanho de baga reduzido. Provavelmente a disponibilidade hídrica na primeira fase de crescimento da mesma é fator determinante para o decréscimo da dimensão da baga, devido a que nesta fase está localizada a maior intensidade da divisão celular, em relação à expansão, conforme discutido acima. De fato, em relação à Safra de verão o cultivo de outono/inverno tem o estabelecimento do fruto e as primeiras fases da formação da baga coincidindo com o final das chuvas de verão; exatamente o contrário ocorre no período da SV, conforme se constata pelos valores de armazenamento da água no solo (Figuras 1 e 2).
Os dados apresentados sugerem que para alguns casos pode ser adequada a recomendação da inversão de safra para Vitis vinifera, com a derrubada de cachos na formação dos mesmos e o cultivo em dupla poda seqüencial, com aproveitamento das duas safras, para as cultivares “americanas” e “híbridas”, na média altitude paulista. Muito embora, mais dados ainda devam ser acrescentados a esta linha de investigação no futuro, as Tabelas 1 e 2, em conjunto com as Figuras 1 e 2 sugerem melhores condições para maturação tecnológica e maturação fenólica da uva na safra de inverno, principalmente para os anos “típicos” onde o cultivo de outono/inverno ocorre sem as flutuações térmicas causadas pela dinâmica de massa polares, que em alguns anos podem estacionar temporariamente sobre a região.
Por outro lado, a inversão de safra citada requer a determinação do índice de carga mais favorável à otimização da maturação e um cuidado bastante rigoroso na adubação do vinhedo. Além disso, um rodízio de áreas de produção é recomendado, para não sobrecarregar o vinhedo, o que poderia causar a queda na vida útil do mesmo. O controle do vigor pode ser feito com o manejo do dossel e/ou manejo no desbaste de cachos, buscando-se o melhor ajuste da carga. A velha máxima de que vigor é qualidade da maturação são mecanismos inversos pode ser verdade, mas para o microclima da média altitude paulista faz-se necessário primeiro estabilizar o vinhedo e depois controlar o índice de carga e o vigor vegetativo. Não obstante, os solos mais pobres poderão render os melhores vinhos, justamente porque aí se tem a chance de melhor controlar a disponibilidade de nutrientes e água. Conforme foi discutida a maturação tecnológica e fenológica da videira ocorre dentro da baga, sob processos altamente influenciados pelo meio físico, o que tem ainda mais importância quando tratamos de Vitis vinifera.
Na média altitude paulista, existem condições críticas que demandam rigor na condução da videira, para melhor aproveitamento das condições do meio objetivando a alcançar melhores índices de maturação; cita-se o vento, o quadrante do ano de maior disponibilidade hídrica, as janelas térmicas de verão e outono/inverno e os solos da região que, em alguns casos, podem armazenar água mais tempo do que o desejado para a melhor qualidade da uva e do vinho local.
Agradecimento Vinícola Família Miqueletto – Louveira (SP) Vinícola Família Lourençon – Itupeva (SP)
Referências
DELOIRE, A.; HUNTER, J.J. Microclimat
des grappes et maturation du raisin berry composition as affected by
bunch exposure. Progrès Agricole et Viticole, v 122, n7, pg.
200-206, 2005.
DELOIRE, A.; OJEDA, H.; ZEBIC, O.;
BERNARD, N.; HUNTER, J.J.; CARBONNEAU, A. Influence de l´état
hydrique de la vigne sur le style de vin. Progrès Agricole et
Viticole, v. 122, n.21, p. 455-462, 2005.
FRANCIS, I.L.; KASSARA, S.; NOBLE,
A.C.; WILLIAMS, P.J. The contribution of glycoside precursors to
Cabernet Sauvignon and Merlot aroma. ACS, Washington, 1999. p.13-30.
GHOLAMI, M.; HAYASAKA, Y.; COMBE,
B.G.; JACKSON, J.F.; ROBINSON, S.P.; WILLIAMS, P.J. Biosynthesis of
flavour compounds un Muscat Gordo Blanco grape berry. Australian
Journal of Grape & Wine Research, v.1, p. 19-24, 1995.
GREENSPAN, M.D.; SHACKEL, K.A.;
MATTHEWS, M.A. Development changes in the diurnal water budget of
the grape berry exposed to water deficits. Plant Cell & Environment,
v. 17, p. 811-820, 1994.
HARRIS, J.M.; KRIEDMANN, P.E.;
POSSINGHAM, J.V. Anatomical aspects of grape berry development.
Vitis, n.7, p.106-109,1968.
HASHIZUME, K.; SAMUTA, T. Grape
maturity and light exposure affect berry methoxypyrazine
concentration quality. American Journal of Enology and Viticulture,
v. 50,
p.194-198, 1999.
KENNEDY, J.A.; HAYASAKA, Y.; VIDAL S.;
WATER, E.J.; JONES, G.P. Composition of grape skin proanthocyanidins
at different stages of berry development. Journal of Agricultural &
Food Chemestry, v. 49, p. 5348-5355, 2001.
KENNEDY, J.A.; MATTHEWS, M.A.;
WATERHOUSE, A.L. Changes in grape seed polyphenols during fruit
ripening. Phytochemesty, v. 55, p.77-85,2000.
LICKER, J.L.; ACREE, T.E.;
HENICK-KLING, T. What is Brett (Brettanomyces) flavor? A preliminary
investigation. In: Chimestry of wine flavor. WATERHOUSE, A.L.;
EBELER, S.E. (Eds). ACS, Washington, 1999. p. 96-115.
MANDELLI, F. ; BERLATTO, M. A. ;
TONIETTO, J. ; BERGAMASCHI, H. . Fenologia da videira na Serra
Gaúcha. Pesquisa Agropecuária Gaúcha, Porto Alegre, v. 9, n. 1-2, p. 129-144, 2003.
McCARTHY, M.G. Weight loss from ripening grapevines (vitis
vinifera L. cv syrah).
Australian Journal of Grape & Wine
Research, v. 5, n.1, p.10-16, 1999. PEDRO JR., J.J.; CAMARGO, M.B.P.;
MORAES, A.V.C; FELÍCIO, J.C.; CASTRO,
J.L.
Temperatura base, graus-dia e duração do ciclo para cultivares de
triticale. Bragantia, Campinas, v 63, n.3, p.447-453, 2004. POSSNER,
D.R.E.; KLIEWER, W.M. The localization of acids, sugars, potassium
and calcium in developing grape berries. Vitis, v.24, p. 229, 240.
ROBINSON, S.P.; DAVIES, C. Molecular biology of grape berry ripening.
Australian Journal of Grape and Wine Research, v. 6, n.2, p.
168.174, 2000.
SANTOS, A.O. ; KAYE, O.
Composição quali-quantitativa da produção de syrah cultivada sob
estresse hidrico transiente. Revista Brasileira de Engenharia
Agrícola e Ambiental, v. 13, p. 272-281, 2009.
SANTOS, A.O.;WAMPLE, R. L. ;
SANDHANDAN, S. ; SETHURAMASAMYRAJA,
B. ;
KAYE, O. . First attempts at instrumenting for grape quality-based
harvesting procedure. In: CIGR International Conference of
Agricultural Engineering, 2008, Foz do Iguacú. XXVII CIGR
International Conference of Agricultural Engineering. Jaboticabal
-SP : SBEA, 2008. v. 1. p. CD ROM.
SPAYD, S.E.; TARARA, J.M.; MEE, D.L.;
FERGUSON, J.C. Separation of sunlight and temperature effects on the
composition of vitis vinifera cv merlot berries. American Journal of
Enology and Viticulture, n. 53, p. 171-182, 2002
WAMPLE, R. L.; SANTOS, A.O. ; KAYE, O.
. Implementation of calibrated near-infrared spectroscopy in
precision viticulture and selective harvesting of wine grapes.
American Journal of Enology and Viticulture, Sacramento, CA, p. 382a
– 395a, 10 dez. 2006. WILSON, B.; STRAUSS, C.R.; WILLIAMS, P.J. Changes in free and glycosidically bound monoterpenes in developing Muscat grapes. Journal of Agricultural & Food Chimestry, v. 32, p. 919-924, 1984. Origem: Instituto Agronômico - IAC - www.iac.sp.gov.br
Antonio Odair Santos
possui graduação em Engenharia
Agronômica pela Universidade do Estado de Santa Catarina (UDESC);
Mestrado e Doutorado em Fitotecnia, pela Universidade Federal do Rio
Grande do Sul (UFRGS); Pós-Doutorado pela California State
University-Fresno (USA) [Viticulture and Enology Research Center].
Atualmente é Pesquisador do Instituto Agronômico (IAC), atuando
principalmente nos seguintes temas: agrometeorologia da videira,
manejo da videira e qualidade de uva/vinho Contato: odairsan@iac.sp.gov.br
Glauco de Souza Rolim
possui doutorado em Agronomia
(Irrigação e Drenagem) pela Universidade Estadual Paulista Júlio de
Mesquita Filho (2003), mestrado em Agronomia (Física do Ambiente
Agrícola) pela Universidade de São Paulo (2000) e graduação em
Engenharia Agronômica pela Universidade de São Paulo (1996).
Atualmente é pesquisador científico do Instituto Agronômico de
Campinas-IAC. Tem experiência na área de Agronomia, com ênfase em
Agrometeorologia, atuando principalmente nos seguintes temas:
Modelagem Agrometeorológica, Micrometeorologia, Balanço Hídrico,
Balanço de Energia, Risco Climático, Citros, Café e videira. Contato: rolim@iac.sp.gov.br
Jose Luiz Hernandes
é Técnico em Agropecuária, formado
pela ETAESG Benedicto Storani de Jundiaí (1987), graduado em
Ciências com Habilitação Plena em Biologia pela Faculdade de
Ciências e Letras Padre Anchieta (1998) e mestrado em Agricultura
Tropical e Subtropical pelo Instituto Agronômico de Campinas (2001).
Em 2006 realizou o Curso Superior de Especialização em Viticultura e
Enologia em Climas Quentes pelo Instituto de Formação Agrária e
Pesqueira (CONSELHO DE INOVAÇÃO, CIÊNCIA E EMPRESA) da Junta de
Andaluzia, no Centro de Pesquisa e Formação Agrária RANCHO DE LA
MERCED em Jerez de la Fronteira, Espanha. Atualmente é Pesquisador
Científico do Instituto Agronômico de Campinas. Tem experiência na
área de Fitotecnia, com ênfase em Vitivinicultura, atuando
principalmente nos seguintes temas: microclima, fitossanidade,
propagação, sistemas de condução, cultivo protegido, variedades de
videira para mesa e indústria e vinificação artesanal. Contato: jlhernandes@iac.sp.gov.br
Mário José Pedro Júnior
possui
graduação em Engenharia Agronômica pela Universidade de São Paulo
(1972), mestrado em Solos e Nutrição de Plantas pela Universidade de
São Paulo (1977) e doutorado em Agrometeorology - University Of
Guelph (1980). Atualmente é pesquisador científico do Instituto
Agronômico de Campinas, revisor de cinco revistas especializadas.
Tem experiência na área de Agronomia, com ênfase em
Agrometeorologia, atuando na área de fruticultura, principalmente
videira, nos seguintes temas: cultivo protegido, sistema de
condução, microclima e zoneamento agrícola. Contato: mpedro@iac.sp.gov.br
Dados para citação bibliográfica(ABNT): SANTOS, A.O.; ROLIM, G.S.; HERNANDES, J.L.; PEDRO JÚNIOR, M.J. A maturação fisiológica da videira vinífera em São Paulo: comentários sobre as safras de verão e de inverno na média altitude paulista. 2009. Artigo em Hypertexto. Disponível em: <http://www.infobibos.com/Artigos/2009_3/maturacao/index.htm>. Acesso em:Publicado no Infobibos em21/09/2009 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||